产品与服务
小鼠肝实质类器官培养基
Mouse Hepatocyte Organoid Basal Medium
小鼠来源的肝实质类器官在病理及基因上高度重现体内组织,可用于疾病建模、机制研究、精准医疗、药敏药筛等方面的运用。小鼠肝实质类器官培养基是一种用于快速在体外培养扩增小鼠肝实质类器官的试剂。
产品介绍
产品信息
| 组成 | 货号 | 规格(100ml) | 规格(500ml) | 保质期 |
|---|---|---|---|---|
| 小鼠肝实质类器官培养基 | NGH010014-C | 100ml | 500ml | 2~8℃,1Year |
| 小鼠肝实质类器官培养基-A | NGH010014-A | 5×500ul | 2×500ul | ≤-20℃,1Year |
| 小鼠肝实质类器官培养基-B | NGH010014-B | 5×300ul | 25×300ul | ≤-20℃,1Year |
- 小鼠肝实质类器官培养基
- 货号NGH010014-C
- 规格 (100ml)100ml
- 规格 (500ml)500ml
- 保质期2~8℃,1Year
- 小鼠肝实质类器官培养基-A
- 货号NGH010014-A
- 规格 (100ml)5×500ul
- 规格 (500ml)2×500ul
- 保质期≤-20℃,1Year
- 小鼠肝实质类器官培养基-B
- 货号NGH010014-B
- 规格 (100ml)5×300ul
- 规格 (500ml)25×300ul
- 保质期≤-20℃,1Year
使用说明
1.配置方式:以配置20mL小鼠肝实质类器官完全培养基为例,在20mL小鼠肝实质类器官基础培养基(NGH010014-C)中加入一支500μL小鼠肝实质类器官培养基A(NGH010014-A)和一支300μL小鼠肝实质类器官培养基B(NGH010014-B),彻底混合。注意:①完全培养基在2-8°C下保存不超过4周,配置完需尽快使用;②小鼠肝实质类器官基础培养基已含有杀菌剂和抗生素,无需额外添加。
2.小鼠肝实质类器官基础培养基补充剂A(NGH010014-A)和小鼠肝实质类器官基础培养基补充剂B(NGH010014-B)采取冰上解冻或者4°C过夜解冻方案,切忌反复冻融补充剂。
操作步骤
肝实质类器官构建流程:
1、接触到类器官的枪头、离心管、和EP管等耗材,都需用DMEM(1%PS+10%FBS)润洗,避免类器官粘壁丢失
小鼠原代肝细胞提取及肝类器官构建流程:
一、小鼠麻醉:
1、将小鼠的头探入离心管中,待其麻醉
注意:越早开始灌注,细胞分离的产量越好
二、肝脏灌注:
2、在37°C浴中预热灌注和消化缓冲液。
3、将麻醉后的小鼠置于以背卧位的姿势置于手术平台上。用胶带将脚和尾巴固定到位。
注意:准备好1或2个额外的胶带条,以便在开始灌注后将输液管固定到位
4、用70%乙醇擦拭腹部。
5、在腹侧中线的皮肤上切开一个切口,然后将皮肤剪开,露出肌肉层。用乙醇洗去头发或碎屑
6、小心地切开腹侧中线,并解剖掉腹肌层,露出内脏。
注意:将皮肤和腹膜分开打开,以避免将毛发带入腹膜腔
7、用弯曲的镊子夹住下腔静脉,用动脉夹夹住上腔静脉
8、将6号静脉输液头皮针平行插入下腔静脉
9、缓冲液进入肝脏后切断门静脉
10、用预热的1xHBSS 灌注10min,流速为7mL/min,直至肝脏清澈(无血)
注意:随着血液被冲出,肝脏应从深红棕色变为均匀的浅棕褐色。如果没有发生这种情况,则说明灌注有问题。检查导管位置和灌注缓冲液的流量
11、改用1mg/mL IV型胶原酶消化缓冲液灌注,消化 20-30 min,流速为7mL/min
注意:灌注至肝脏塌陷,按压后有凹陷,难以恢复
三、肝细胞分离:
12、灌注完成后,取出导管并小心切除肝脏。
注意:此时肝脏应该非常脆弱,破裂可能会导致细胞损失
13、将肝脏置于预冷的DMEM(1%PS+10%FBS)中
14、划破肝组织,用镊子夹住肝组织在预冷DMEM(1%PS+10%FBS)中来回抖动,释放肝细胞
15、通过70μm细胞过滤器,将细胞过滤到50ml离心管(冰上)中。用预冷DMEM(1%PS+10%FBS)稀释至约30ml。以50g,离心5min,4°C
注意:细胞筛需用DMEM(1%PS+10%FBS)提前润洗
16、倒出上清液,轻轻地将细胞(通过倒置管)重悬于10ml预冷的35%Percol中,充分混合并转移到15ml管中
17、离心450g,15min,4°C。死细胞将位于溶液的顶部。丢弃上清液。
18、用10ml预冷DMEM(1%PS+10%FBS)轻轻重悬细胞。以50g,离心2min,44°C,重复一次
19、最后一次洗涤后,将细胞重悬于预冷DMEM(1%PS+10%FBS)中
20、用血细胞计数器计数细胞数
21、按细胞悬液:基质胶=1:3将细胞稀释至适当浓度,以18-25μL种于48孔板中,将48孔板置于培养箱中15-20min,基质胶凝固后加入肝类器官培养基(NGH010014)
注意:混匀和种板时,使用移液枪不要按到底,避免出现气泡
23、、37℃和 5% CO2下进行培养。每2-3 天进行一次换液
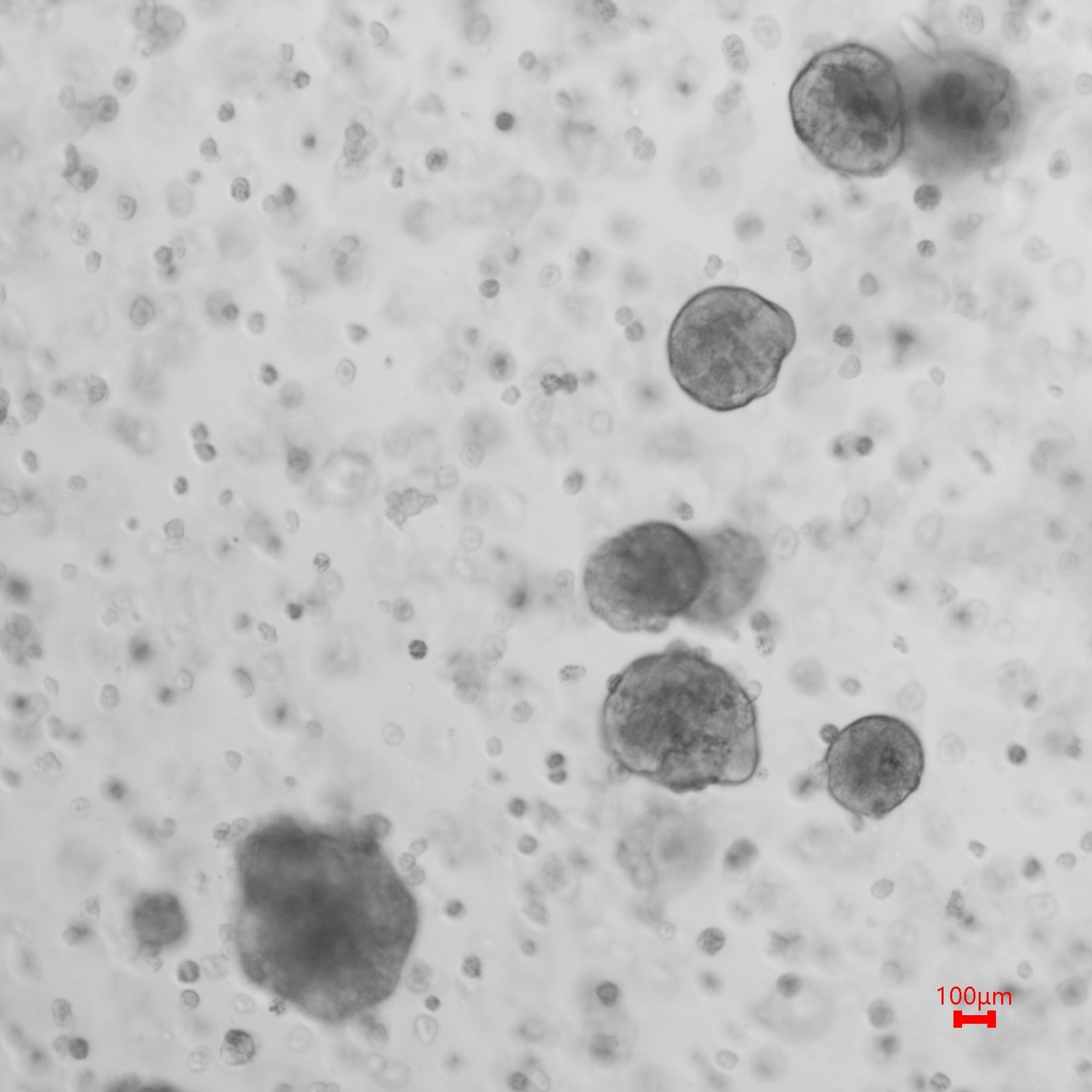
培养效果图